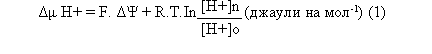Метаданни
Данни
- Включено в книгата
- Година
- 2012 (Пълни авторски права)
- Форма
- Научен текст
- Жанр
- Характеристика
- Оценка
- 6 (× 1 глас)
- Вашата оценка:
Информация
- Корекция
- д-р Никола Пировски (2015 г.)
- Форматиране
- cattiva2511 (2021 г.)
Издание:
Автор: Любомир Т. Пировски; Никола Л. Пировски; Йорданка Стайкова-Пировска
Заглавие: Искам — мога — трябва
Издание: първо (не е указано)
Издател: Издателство Бон
Град на издателя: Благоевград
Година на издаване: 2015
Тип: научнопопулярен текст
Националност: българска (не е указана)
Печатница: Издателство Бон
ISBN: 978-954-395-126-0
Адрес в Библиоман: https://biblioman.chitanka.info/books/14584
История
- — Добавяне
2. Холистично адаптивно въздействие — „мишените“ стрес и клетъчни мембранни биоенергитични системи
Още Ханс Селие (1936 г., 1974 г.), отбелязва три стадия в протичането на стресовата реакция — „тревога“, „резистентност“, „изтощаване“ и определя стреса като неспецифична нервно-ендокринна реакция. Днес с развитието на кибернетиката и учението за функционалните системи в организма, стресът се приема като поведенческа хомеостатична реакция, чийто контур се отваря от енергийния недостиг и се затваря при задоволяването на този недостиг. При това синтезирането на белтъците, мазнините, въглехидратите и нуклеиновите киселини се „изплаща“ чрез аденозинтрифосфат (АТФ).
Адаптивното оптимизиране на енергетичното състояние на живата клетка, а от там и на нейното физиологично и биосинтезиращо състояние, става чрез оптимизирането на енергизацията на мембраните й, тъй като именно клетъчните мембранни биоенергитични системи са в центъра на получаване на конвентируема енергия използвана от живата растителна и животинска (човешка) клетка.
Всяка мембранна система изпълняваща енергитична функция превръща химическата или светлинна енергия в електрическа-трансмембранна разлика на електрическите потенциали (ΔΨ) или осмотична енергия от концентрационната разлика на разтворените вещества от двете страни на мембраната.
Превръщането на енергията в биомембраните е по следната схема: (Скулачев В. П, Энергетика биологических мембран, „Наука“ Москва 1989)
„енергетични ресурси → ΔμI →работа“
където ΔμІ е трансмембранна разлика в електрохимическия потенциал на йона I. Ролята на такъв йон играят H+, Na+, Ca+, K+, CL-. При това ΔμCa+, ΔμК+, ΔμCL- играят роля само в понижаване на концентрациите на тези йони в цитозола и никога не се използват за извършване на работа, докато енергията на Δμ H+ и Δμ Na+ може обратимо да се превръща в енергия на АТФ. Ето защо „конвертируемата енергетична валута“ на живата клетка е ΔμН+ (във вътрешната мембрана на митохондриите; обвивката на хлоропластите; външната мембрана на клетките на растенията и гъбите и мембраните на техните вакуоли и др.), ΔμNa+ (на външната клетъчна мембрана на животинската клетка) и АТФ (в останалите немембранни части на клетката). Мембраните на лизозомите, апарата на Голджи, външната мембрана на клетките на лигавицата на стомаха създават йонен градиент по схемата:
АТФ → ΔμН+. Енергията на Δμ H+ и Δμ Na+ може обратимо да се превръща в енергия на АТФ.
Трансмембранната разлика в електрохимическите потенциали (Δμ H+, или протонен потенциал) се състои от два компонента: електрически (ΔΨ) и химически (Δ pH).
Енергията, натрупана под формата на Δμ H+ (протонен потенциал) е:
където ΔΨ е трансмембранната разлика в електропотенциалите, R — газовата константа; T — абсолютната температура; F — числото на Фарадей; [H+]n и [H+]o — моларните концентрации на йоните H+ в съответно положително заредената (по-кисела) или в отрицателно заредената (по-алкална) зона от двете страни на мембраната.
За измерването на Δμ H+ във волтове, тази величина трябва да се раздели на числото на Фарадей. Полученото частно се нарича протондвижеща сила (Митчел) и се означава ΔР.
При 25° С ΔР = ΔμН+/ F= ΔΨ–0, 06 ΔpH (2)
където pH е отрицателният логаритъм от концентрацията на водородните йони. Следователно ΔР= 1 е еквивалент на = 0, 06 V или 60 mV.
Енергийните ресурси, използвани от мембранните системи отначало се изразходват за транспорта на йона І през мембраната против силите на електрическото поле и в посока на по-голямата концентрация на йона І. Този процес се нарича енергизация на мембраната. След това енергията натрупана в електрическа или осмотична (концентрационна) форма се използва в качеството на движеща сила за да се извършва полезна работа.
Химическите реакции на преноса на електрони от донора на електрони (редуктор) към акцептора на електрони (окислител) т.е. оксиредукционните реакции играят решаваща роля в обмяната на веществата и енергията. По същество дисбаланса на тези два процеса е основата на патологията на живата клетка, а тяхното стабилно отклонение от нормата е причина за превръщането на адаптационния процес в болест. Повлиявайки дисбаланса на окислително-редукционни процеси, можем да възстановим равновесието. На клетъчно ниво това може да се обясни с нарушаване на процесите, протичащи в митохондриите. Синтеза на АТФ е свързан с постоянното поддържане на оптимална протондвижеща сила (ΔР). ΔР е толкова по-голяма колкото е по-голяма разликата на моларните концентрации на водородни йони от двете страни на вътрешната митохондрийна мембрана, съгласно уравнение (1) и (2). При това енергийният стресов хомеостат съгласно кибернетичния модел на стресовата реакция по (схема на Ив. Маджаров 1998 г.) се включва от пониженото парциално налягане на кислорода в кръвта (кислороден недостиг), повишената киселинност на кръвта (млечна киселина) и изместването на равновесието АДФ -> АТФ наляво още преди да се получил остър енергиен дефицит. Равнището на АТФ остава в главни линии непроменено, защото стресът като голям многопараметърен механизъм поддържа докато може (до края на трети стадий) константно енергийното равнище в организма, независимо от това, колко е голям натискът на околната среда върху него. В тази светлина адаптацията (оздравяването) може да се приеме не като нагаждане на организма към обкръжаващата го среда, а като запазване на неговите физиологични константи (хомеостаза) въпреки промените в обкръжаващата среда. Така в реакцията „стрес“ се отразява логиката на принципа „всичко или нищо“, характерен за физиологичните реакции на човека и животните.
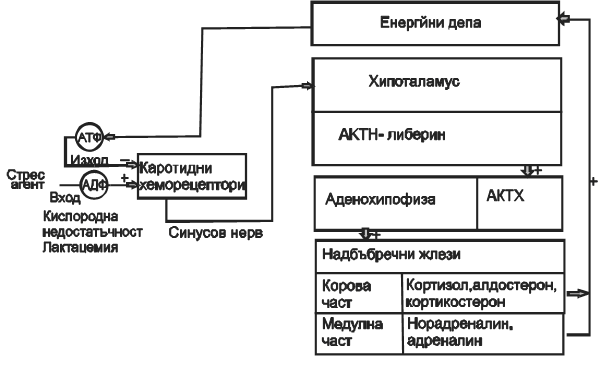 Схема: Кибернетичен модел на стрес (Маджаров И., Стресът при животните- мит и действителност, Земиздат, София, 1988)
Схема: Кибернетичен модел на стрес (Маджаров И., Стресът при животните- мит и действителност, Земиздат, София, 1988)
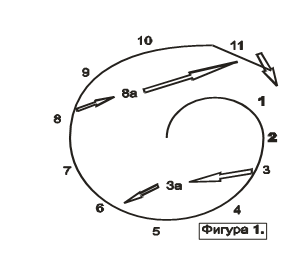
Нормализирането на функциите на системите в организма води до възстановяване на нарушената му саморегулация, в чиято основа стои взаимодействието на противоположно насочени физиологични процеси. Възстановяването на изходното състояние на физиологичния процес не е възвръща- не към старото, а е достигане на качествено ново състояние. Движението на целия регулаторен процес се извършва не като кръгово, а по своеобразна спирала:
1. Активност на центровете на симпатиковата нервна система.
2. Образуване на адреналин и норадреналин.
3. Натрупване в кръвта на адреналин и норадреналин.
3.а. Повишаване на проницаемостта на хематоенцефалната бариера за адреналин и норадреналин.
4. Повишаване на артериалното налягане.
5. Усилване дразненето на съдовите рефлексогенни зонисинокаротидна, сърдечноаортална и барорецепторна (в надбъбречните жлези)
6. Активиране центровете на парасимпатиковата нервна система
7. Образуване на ацетилхолин.
8. Натрупване в кръвта на ацетилхолин.
8.а. Повишаване проницаемостта на хематоенцефалната бариера за ацетилхолина.
9. Намаляване на артериалното налягане.
10. Намаляване дразненето на съдовите рефлексогенни зони.
11. Активация на центровете на симпатиковата нервна система.
Електроактивирана вода — холистичен адаптационен енергиен клетъчен биостимулатор и инхибитор
Енергитичното състояние на живите клетки в биологичен организъм може да се стимулира или инхибира чрез въздействие от фракции от електроактиви-рана вода (Пировски Н., Пировски Л., Електроактивирана водафункциона-лен енергетичен клетъчен биостимулатор и инхибитор. Научна конференция с международно участие „СУБ Стара Загора 2003“. Том ІІІ, стр. 45–50, 05–06.VI.2003).
Особено интересно е приложението на електроактивираната вода в геронтологията (Подколзин, А.; Донцов, В., 1996 — Старение, долголетие и биоактивация, Москва, стр. 19–24 и стр. 96–102), и като екологично чисто, безвредно, бактериостатично и бактериоцидно, антиоксидантно и биостимулиращо средство на клетъчно ниво.
Водата като химическо съединение e с фундаментално физиологично действие в живия организъм (растителен, животински, човешки). Целенасоченото променяне на някои основни характеристики на природната вода, влияещо програмирано на връзката „структура — активност“, е възможно само при електрохимическата й обработка.
Както е известно (Богданова Р., 1985, Химия-традиционная и парадоксальная., „Издательство Ленинградского Университета“ Ленинград, стр. 88–113)
{im:scheme_2.png}
При електролизата на водата по посочената принципна схема с инертни анод и катод (въглен, титан или платина) и разделяща мембрана от целофан или порьозна керамика, на електродите става окисление и редукция на молекулите на водата съгласно реакциите:
Катод−: 2H2O + 2e− → H2 + 2OH− или 2H+ + 2e− → H2 (H3О2-) → (хидратиран електрон) т.е. редукция, pH = 9 до 12, т.е. — донор на е-; акцептор на протони; „твърд“ нуклеофилен реагент, католитна фракция („жива вода“) — редуктор
Анод+: 2H2O − 4e− → O2 + 4H+
или
2OH− − 2e− → H2O + ½O2 (H3O+; H5O2+) хидратиран протон, окисление; pH= 1 до 3 тоест − донор на протони; акцептор на е−; „твърд“ електрофилен реагент; анолитна фракция
(„мъртва вода“) — окислител.
Католитът (pH от 9.5 до 12) коригира тъканната ацидоза, стимулира процесите на регенерация на тъканите и има имуностимулиращи свойства.
Анолитът (pH от 2 до 3) има стимулиращи свойства за регенерация на тъканите и детоксикацията им и бактериостатичен ефект. При добавяне на NaCl 0.3- 3– 9 гр/л към водата преди нейната електрохимическа обработка този анолит придобива бактерицидни свойства на база активен хлор от 0.02 до 0.06% и оксиредукционен потенциал + 1150 mV поради което е особено подходящ за стерилизиращи, миещи и дезинфектиращи разтвори. Методът включващ електроактивирането на воден солеви разтвор е ефективен за пречистване на питейна вода от микроорганизми до 99.99%, от органични вещества 50 до 90%, и от тежки метали 50 до 80%. (М.З., СССР, 18.09.1991, Методические указания по применению электрохимическ активированых растворов NaCl (анолит, католит), выработываемых в устройстве ЭХА-30 для целей дезинфекции, предстерилизационной очистки и стерилизации, утвержденно — Главного санитарно-эпидемиологического управления, № 15–6/22)
В приелектродните зони се образуват различни окислително-редукционни системи, pH на който значително се различава. Взаимовръзката между pH и оксиредукционния потенциал за тези системи е:
Е Осист. = 1,23 − 0,06 pH + 0,015 lg PO2;
Е Нсист. = –0,06 pH − 0,03 lg PH2
Където Е Н-сист. и Е О-сист. са оксиредукционните потенциали на водородната и кислородната системи съответно, а PH2 и PO2 парциалните налягания на водорода и кислорода, пропорционални на съдържанието на тези газове във водата. При насищане на анолитната вода с кислород и католитната вода с водород (при постоянство в парциалните им налягания) величината Е линейно зависи от pH. Характерно е, че и анолитната фракция и католитната фракция от природни води се отнасят към другите вещества като силни киселини и основи; адхезията им към повърхността на твърди тела е увеличена; с увеличаване времето на активация, повърхностното напрежение на водата се увеличава, като това не е свързано с изменението на pH във времето. При анолитната фракция, успоредно с намаляването на pH става увеличаване на окислително-редукционния потенциал. При католитната фракция оксиредукционния потенциал е нестабилен и се променя във времето даже в херметично затворен съд. Редукционните свойства на католитната фракция вероятно освен на разтворения молекулен H2 се дължат и на атомарен H и хидратиран електрон. Тези частички се образуват в католита в резултат на студена емисия на електрони от катода под влияние на високия градиент на електрокинетичния потенциал в двойния слой на границата „електрод — разтвор“.
От физикохимична гледна точка на фазовите граници твърдо/течно: „твърд графитен електрод/течна водна фаза“, „биомембрана/цитозол в клетката“ възниква двоен електрически слой вследствие на неравномерното разпределение на носителите на електрическия товар (йони или електрони), блокирвани поради отделяне на газови фази от водород и кислород, като и вследствие специфичното ориентиране на полярните водни молекули, йонизиране на функционални групи или предпочитана адсорбция на йони.
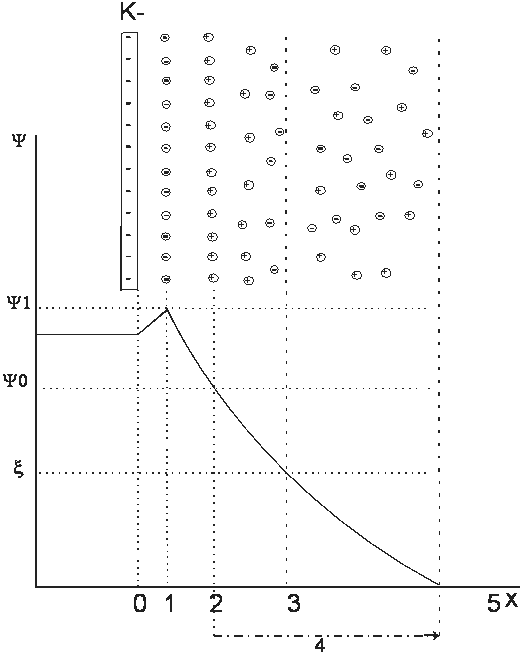
X — разстояние от фазовата граница; O — фазова граница; 1, 2, 3, 4, 5, — различни слоеве от електрични товари;
Граничната повърхност със съответните двойни слоеве при неподвижен флуид и липса на други външни сили е общо една електронеутрална система.
Ако към системата се приложи външно електрично поле или/и се създадат условия за неравномерно разпределение на йоните чрез принудителното им придвижване от слоеве подвижен флуид, се получава потенциална разлика между граничните повърхности 2 и 4, така наречената равнина на срязване. Тази потенциална разлика се нарича зета потенциал (ξ) или електрокинетичен потенциал, тъй като се измерва чрез тангенциалното изместване на подвижните частички на електрическия двоен слой.
Елеткрокинетичния потенциал е 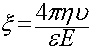 , където η — вискозитет на средата; ν — скорост на преместване на частичките; Е — градиент на потенциала на външното електрическо поле; ε — диелектрична константа на разтворителя.
, където η — вискозитет на средата; ν — скорост на преместване на частичките; Е — градиент на потенциала на външното електрическо поле; ε — диелектрична константа на разтворителя.
Положението на равнината на срязване или стойността на електрокинетичния потенциал може да се променя чрез: имобилизиране водни слоеве на фазовата граница „твърдо/ течно“; специфична адсорбция на противни съответно койони; повишена концинтрация на индиферентни електролити; вискозитетни или диелектрични промени в дифузионния слой.
Получените в католитната фракция електрони след това се хидрират, а при взаимодействието им с водата се отделя атомен Н. При това, при изместване на pH на католита към алкална среда, съотношението между съдържанието във водата на атомен h и хидратиран електрон се измества към преимуществено образуване на хидратирани електрони. Освен това в католита от природни води, се увеличава концентрацията на катионите Ca2+, Mg2+, Na+, K+ и др. Възможно е и възникването на вторични свободно-радикални процеси, инициирани от първичните радикали (H2O2, OH−, H+, H3О2-). При това е възможна стабилизация на образуващите се продукти в изменената структура на водата, което позволява запазване на аномалните свойства на водата продължително време (от 1 до 5 денонощия за католитната фракция на обработената вода, и до 1 година за анолитната фракция).
Възстановяването на равновесието при оксиредукционните процеси може да стане и като се използват вещества — донори на електрони, т.е. антиокислители (напр. Витамините E, C, P, PP, K и др.). Антиокислителната активност на тези вещества е свързана с наличието в тях на подвижен атом Н, който е универсален редуктор (донор на е-). Молекулата на антиокислителя (А) се представя под формата на вид А-Н, където Н е подвижният водороден атом (протон)
Тогава: R• + A − H → RH + A• или ROO• + A − H → ROOH + A• тоест при такава реакция става заместване на активните радикали в субстрата R. или ROO. с малкоактивния радикал А., кой- то не е способен да продължава веригата на свободно-радикално окисление и се превръща в стабилни молекулни продукти.
Антиоксидантите обаче не могат да постигнат нужната промяна от порядъка на десетки mV, тъй като необходимите количества за това са десетки грамове. За ΔpH = 1 еквивалентната ΔΨ е = 0,06 V или 60 mV. При католит с pH= 9.5 до 12 оксиредукционният потенциал е не по-малко от минус 800 mV. Ето защо като целево конструиран донор на електрони (респективно увеличаване на редуциращите потенциали, а от там и за увеличаване на ΔμН и ΔμР) се използва католитната фракция („жива“ вода), особено като се има предвид и нейните структурни особености — хидратирани електрони и водородни връзки позволяващи пренасянето на протони H (H5O2+ или H3O+) от една водна молекула към друга или към активните радикали в субстрата R• или ROO•.
Химическите реакции на преноса на електрони от донора на електрони (редуктор) към акцептора на електрони (окислител) т.е. оксиредукционните реакции играят решаваща роля в обмяната на веществата и енергията. По същество дисбаланса на тези два процеса е основата на патологията на живата клетка, а тяхното стабилно отклонение от нормата е причина за превръщането на адаптационния процес в болест. Доставяйки електрони повлияващи дисбаланса на процесите протичащи в митохондриите се променя ΔΨ на митохондриалната мембрана, и се ускорява преноса на протони от матрикса в междумембранното пространство. Това се последва от усилен синтез на АТФ и натрупване на редуцирани (възстановени) биохимични съединения, например ензимни системи за невротрансмитерите в невроналните клетки или в синапсисите, чрез които нервните импулси се превръщат в хормонални сигнали.
Синтеза на АТФ е свързан с постоянното поддържане на оптимална протондвижеща сила (ΔР). ΔР е толкова по-голяма колкото е по-голяма разликата на моларните концентрации на водородни йони от двете страни на вътрешната митохондрийна мембрана, съгласно уравнение (1) и (2). Тъй като ΔР зависи от разликата между електрическия (ΔΨ) и химическия (ΔpH) трансмембранен потенциал, при по-стръмното увеличаване на ΔΨ от ΔpH, ще се получава увеличаване на ΔР и организма ще оздравява и нараства, тоест нервнохуморалната регулация на функционалните системи ще се оптимизира.
В крайна сметка допълнителната външна енергизация на мембраните на живата клетка рефрактира през ензимните й системи и биохимичните и физиологични реакции, в подобряване и активиране на живота на организма.